
Covid: les vaccins de Pfizer et Moderna ciblant Omicron autorisés aux Etats-Unis
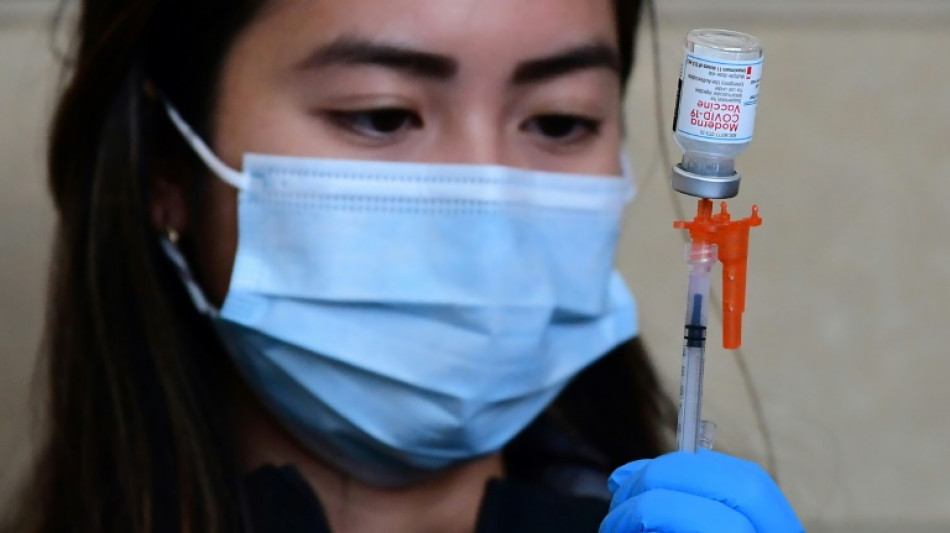
Les autorités sanitaires américaines ont autorisé mercredi la nouvelle version des vaccins contre le Covid-19 de Pfizer et de Moderna visant spécifiquement le variant Omicron, dans l'espoir de mieux contenir une nouvelle vague de contaminations redoutée cet hiver.
Les deux vaccins actualisés sont autorisés pour une dose de rappel, dès 12 ans pour celui de Pfizer, et à partir de 18 ans pour celui de Moderna, a précisé l'Agence américaine des médicaments (FDA) dans un communiqué.
Cette nouvelle génération de vaccin anti-Covid, dit bivalent, cible à la fois la souche originelle du coronavirus, et les lignages BA.4 et BA.5 du variant Omicron. Ce dernier lignage représente actuellement près de 90% des contaminations aux Etats-Unis.
"Une nouvelle vague est attendue lorsque nous passerons davantage de temps en intérieur, cet automne et cet hiver", a averti lors d'une conférence de presse Robert Califf, le patron de la FDA, indiquant qu'il s'agissait "d'anticiper" cette hausse des contaminations.
Même si le virus s'est largement effacé du quotidien des Américains, les Etats-Unis enregistrent toujours actuellement quelque 80.000 nouveaux cas et 400 morts du Covid-19 chaque jour.
Plus tôt cet été, le ministère de la Santé américain avait annoncé avoir acheté 105 millions de ces nouvelles doses à Pfizer, et 66 millions à Moderna.
Ces vaccins actualisés doivent encore être recommandés par les Centres de prévention et de lutte contre les maladies (CDC) pour que les injections puissent commencer. Un comité d'experts indépendants doit être réuni par les CDC pour en discuter dès jeudi. Puis la directrice de cette agence, Rochelle Walensky, sera chargée de donner son feu vert final.
Les deux compagnies ont indiqué que les nouvelles doses étaient prêtes à être envoyées, afin d'être potentiellement disponibles dès la semaine prochaine dans le pays.
Restera à convaincre les Américains de réaliser ces nouvelles piqures, alors que déjà seulement environ la moitié des personnes éligibles ont fait leur première dose de rappel.
- "Restaurer" l'immunité -
La vaccination initiale restera pour le moment proposée avec les vaccins antérieurs, afin de fournir une "base" d'immunité, a déclaré M. Califf.
Les rappels actualisés pourront être faits à partir de deux mois après avoir reçu une dose précédente (rappel, ou vaccination initiale). Le dosage est de 30 microgrammes pour Pfizer, et 50 microgrammes pour Moderna.
Les vaccins actuellement en circulation étaient pour le moment basés uniquement sur la souche initiale du virus apparu à Wuhan en Chine, mais ils se sont peu à peu révélés moins efficaces contre les variants apparus au fil du temps, à cause de l'évolution rapide du virus.
Pour son autorisation, la FDA se fonde notamment sur des essais cliniques menés pour évaluer une autre version actualisée du vaccin, utilisant le lignage BA.1. Cette version du vaccin de Moderna a été autorisée au Royaume-Uni mi-août.
Les vaccins utilisant spécifiquement BA.4 et BA.5 n'ont eux pour le moment été évalués que dans des études pré-cliniques sur des animaux.
Mais les autorités sanitaires martèlent que la sécurité des vaccins n'est en aucun cas menacée par ce changement de souche. "Ce que nous faisons ici est ce que nous faisons chaque année pour le vaccin contre la grippe", a rappelé Peter Marks, de la FDA.
Certains experts américains ont toutefois émis des interrogations sur l'étendue de l'efficacité renforcée que ces vaccins actualisés pourraient apporter, celle-ci ne pouvant être mesurée que via des essais cliniques.
"L'espoir" est de "restaurer" un niveau d'immunité similaire à celle conférée par les vaccins au moment où ils avaient été lancés, et de procurer une "durée de protection plus longue", afin de ne pas avoir à répéter les rappels trop souvent, a déclaré Peter Marks.
Des études seront conduites pour évaluer l'efficacité réelle.
Interrogé sur la nécessité d'inclure la population jeune dans cette vaste campagne de rappel, M. Marks a souligné que ces vaccins pourraient notamment aider à protéger contre le "Covid long", qui touche tous les âges.
Pfizer et Moderna ont également déposé une demande d'autorisation pour une version mise à jour de leur vaccin auprès de l'Agence européenne des médicaments (EMA).
F.González--ESF